首頁  儀器設備儀器設備
儀器設備儀器設備
全內反射螢光顯微鏡暨轉盤式共軛焦顯微鏡 Laser TIRF/Spinning Disc confocal
本儀器可進行三種模式的拍攝模式, 第一種為TIRF全反射螢光拍攝模式,第二種為spiing disc confocal轉盤式共軛焦拍攝模式,第三種為一般螢光拍攝模式。
 儀器外觀
儀器外觀
 |
 |
| 顯微鏡系統外觀,全罩式大型不透光培養箱,溫度穩定且TIRF雷射不會穿出不透光之培養箱,不會有雷射傷害眼睛之安全疑慮。 | spinning disc confocal 模組搭配1K*1K EMCCD |
 |
 |
| 機身左側分光spinning disc confocal 模組 | 機身右側之TIRF slider |
 |
|
| TIRF訊號由右側 512*512 EMCCD擷取。 | |
 |
 |
| Living cell 組合式chamber與其載物台加熱底座,亦適用於3.5mm dish | 另備有可以觀察12 well塑膠底盤的物鏡與底座、長時間培養裝置 |
全反射螢光顯微鏡TIRF
Carl Zeiss Laser TIRF 3
儀器管理人
羅安琦副技師
服務項目
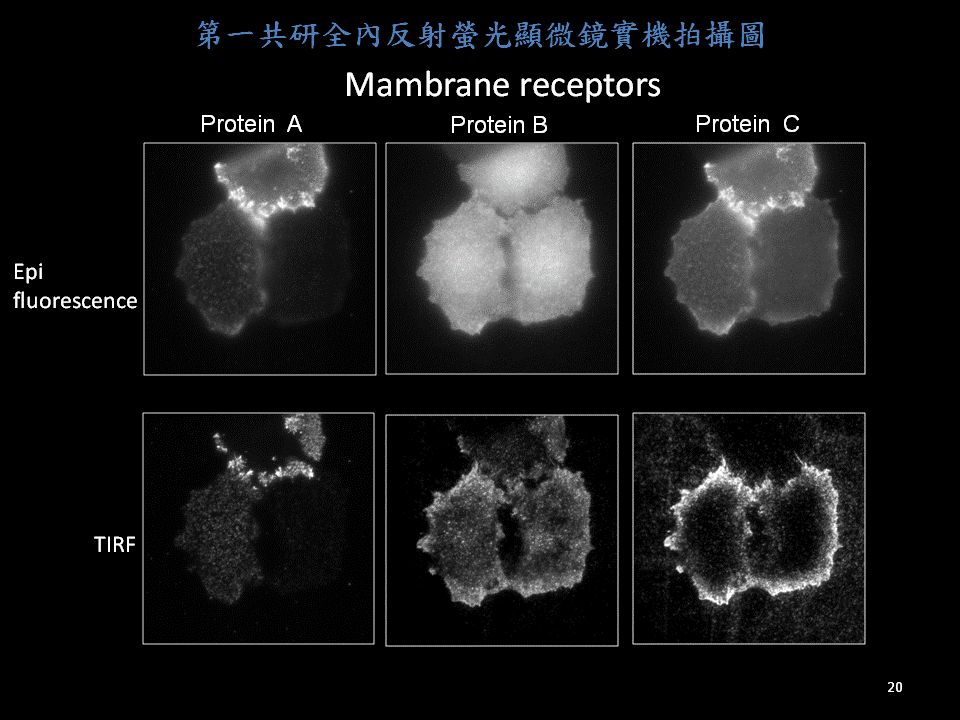
1. TIRF影像,觀察貼近蓋玻片表面區域之螢光訊號,如focal adhesion、細胞膜相關之生理作用
2. calcium imaging,需要高速影像擷取等應用。:Fura-2 ,Fluo-3/ Fluo-4 calcium imaging
規格與應用特色說明
Laser : 405nm, 488nm, 561nm, 633nm by AOTF control
電動載物台 : 支援長時間多位置拍攝與大面積拼圖應用
大型全罩式活細胞培養裝置 : CO2、溫度、濕度控制
高感度EMCCD Photometrics Evolve 512 ,專門適用於微弱螢光與需要高速攝影的螢光訊號記錄。
為避免因多孔盤不相容問題,請使用者在上機前攜帶空盤來試擺看是否相容。
TIRF原理與生物應用介紹
所謂全反射現象是指光線全反射,以電磁波的觀點來看,在發生全反射的介面,電磁場會透入一小段距離,我們叫這個電磁波為漸逝波(evanescent wave)。因漸逝波強度成指數衰減,如果在非常靠近介面的地方有螢光分子,漸逝波仍然有能力去激發這個螢光分子,因而產生螢光。漸逝波分佈的區間我們稱為evanescent field 漸逝區間,其深度大約為200nm。
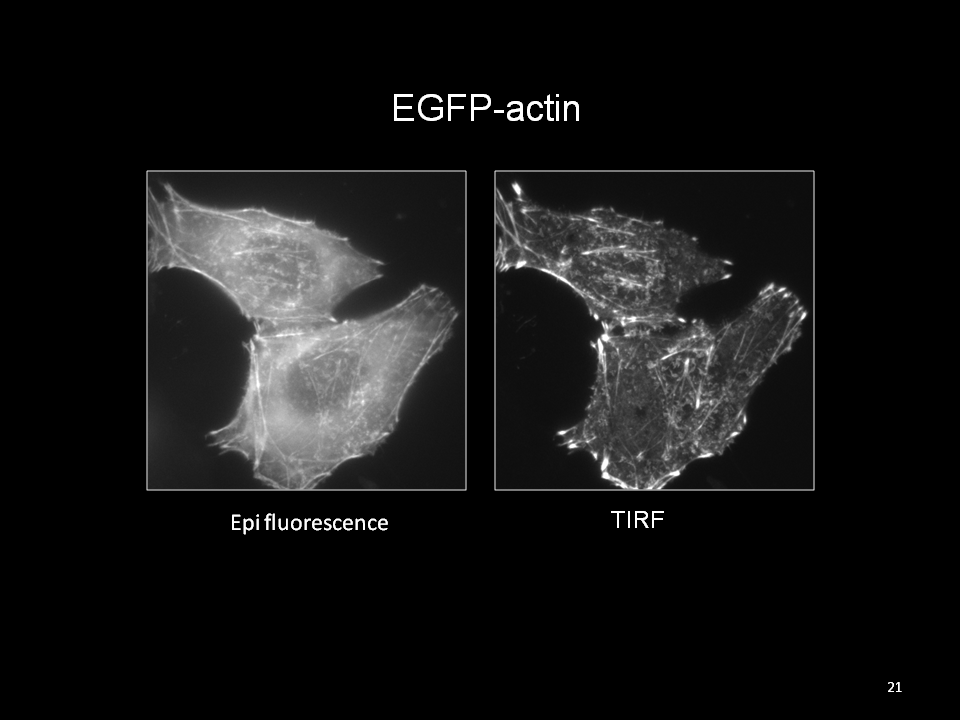
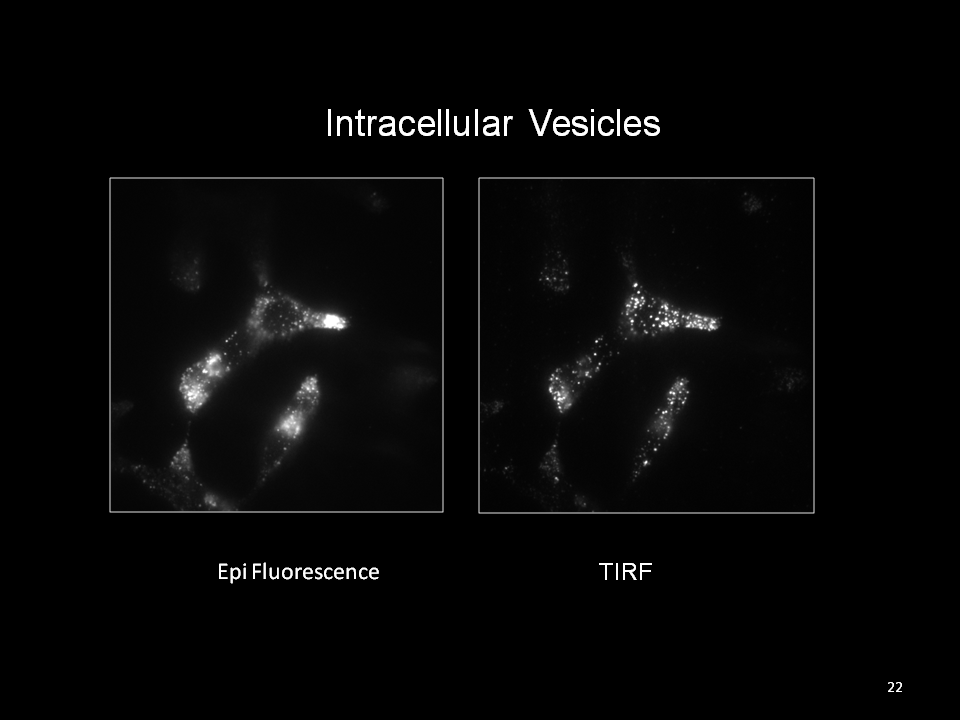
若將此特性應用在螢光顯微鏡上,利用漸逝波範圍觀察貼附於靠近蓋玻片200nm以內所發生的螢光反應,例如表現於細胞膜附近的focal adhesion螢光蛋白。若超過此漸逝波可穿透的深度則不會被觀察到。由於只觀察得到靠近玻片表面淺層的螢光訊號,所以TIRF影像於細胞模式應用時可避免細胞整體其他螢光訊號的干擾,而得以提升影像S/N ratio 得到清晰的細胞表面淺層訊號 。

TIRF顯微鏡應用範圍建議: 觀察貼附於蓋玻片上之細胞膜行為,例如: 胞吞、胞吐作用、細胞貼附及爬行過程、蛋白運送(protein trafficking) 、細胞膜受體(receptor)與接合子(ligand)的反應等。

圖為各種螢光觀察方式其光學觀察範圍與細胞的空間關係,左至右說明如下:
- TIRFM觀察的空間限於貼附於蓋玻片的表面。
- 雷射共軛焦顯微鏡(例如一共的Leica SP5)則以pinhole篩選焦距面內的光進行觀察,達到光學切片的效果。
- 一般螢光顯微鏡,焦距面上下層螢光互相干擾,所以影像易模糊不清。
- Spinning Disc Confocal,利用佈滿pinhole高速轉盤製造光學切片效果。
TIRF上機樣品備製要點
- 事先至第一共同研究室索取或自行準備下述規格圓形蓋玻片,將玻片置於培養皿中,使細胞長於蓋玻片上,上機前組合成下圖之chamber即可上機觀察。
| Re-usable chambers with replaceable coverslips | |
 |
 |
| 30mm mini組合式chamber | 42mmPOC-R2組合式chamber |
- 玻片使用前以酒精消毒,置於無菌操作台UV燈下照射後使用 ,但勿滅菌,以免玻片變形。
- 玻片厚度為標準厚度0.17mm ,折射率約為1.515,大小為直徑 30mm 或者 42mm 的圓形蓋坡片。
- 此外若需要使用螢光效果更好的100X /N.A.1.57物鏡,需要使用折射率更高寶石片(折射率1.66),也可向一共購買該耗材,每片新台幣2000元。
下列樣品條件將無法觀察TIRF
- 載玻片樣品,由於沒有水存在形成折射率的差異,無法滿足形成全反射的條件。
- 無貼附性樣品,例如果蠅胚胎,由於不像細胞是貼附生長於蓋玻片上所以產生TIRF效果欠佳。
- 於一般塑膠Petri Dish或厚坡璃底chamber slide 上的樣品。
 |
 |
轉盤式共軛焦顯微鏡 SPINNING DISC CONFOCAL MICROSCOPE Carl Zeiss Cell Oserver SD
(YOKOGAWA CSU-X1)

服務項目
- 共軛焦影像拍攝,一般標準slide或活細胞。
- 長時間活細胞樣品多位置、多重螢光拍攝
- 組織樣品大面積拼圖應用
規格與應用特色說明
- Laser : 405nm, 488nm, 561nm, 633nm by AOTF control
- YOGOGAWA
- 電動載物台 : 支援長時間多位置拍攝與大面積拼圖應用
- 大型全罩式活細胞培養裝置 : TIRF專用不透光 提供CO2、溫度、濕度控制
- 高感度SCMOS Photometrics 95B
- 亦可應用於快速反應如鈣離子濃度變化,需要高速影像擷取等應用。
- 為避免因孔盤不相容問題,請使用者在上機前攜帶空盤來試擺看是否相容。https://www.thermofisher.com/order/catalog/product/155382?ICID=search-product
樣品限制
- 使用油鏡拍攝高解析影像請選擇#1.5 或 #1.5H coverslip (0.17mm)之標準蓋玻片以呈現最佳解析效果,可向影像核心索取或購買。
- 不要使用塑膠底盤的dish或multi well plate ,可以自行購買底盤厚度#1.5玻璃底的多孔盤(參考品牌ibidi;ThermoTM ; MatTek)請先詢問管理員。
-

glass bottom dish 範例 
#1.5 或 #1.5H coverslip (0.17mm)之標準蓋玻片外盒,螢光標示處為厚度描述
原理與生物應用介紹
一般的雷射點掃描共聚焦系統 (Laser point scanning confocal, 如: LSM880)中,雷射以單點的方式一點接著一點進行影像掃描,再運用pinhole技術確保只有來自焦平面的訊號被detector接收,此系統確保高共聚效果但缺點為十分耗時且容易造成phototoxicity 及 bleaching。若須要進行活細胞快速影像擷取時,則可以使用轉盤式共聚焦顯微鏡,此系統一樣可達到共聚焦效果且掃描速度快。
本單位轉盤式共聚焦顯微鏡使用Yokogawa CSU-X1系統,系統中含有一個特殊設計的圓盤Nipkow-disc,圓盤上具有多個以螺旋狀排列的pinhole (Fig1)。當此圓盤旋轉時,其上的pinhole逐漸移動並掃描全視野樣本,此系統同時使用1000個pinhole進行雷射掃描 (Fig2)。由於雷射光源經過Nipkow-disc後強度將減弱至只剩1-2%,因此在Yokogawa CSU-X1系統中增加microlens圓盤,光源經過microlens聚光後光源將提升至70% (Fig3)。兩轉盤以1800-5000 rpm的轉速進行影像掃描,激發的螢光訊息再次經過圓盤上的pinhole以達到移除非焦平面訊號的功能,最後影像以EMCCD擷取 (Fig4)。
 |
|
Fig1. Nipkow-disc示意圖 |
 |
|
Fig2. 圓盤旋轉時,螺旋狀排列pinhole以曲線進行掃描,因此可逐漸掃描全視野 |
 |
|
Fig3. Yokogawa CSU-X1運用Microlens增加雷射光源強度 |
  |
|
Fig4. 轉盤式共軛焦顯微鏡系統內部光路示意圖 |
轉盤式共聚焦顯微鏡適用於以下觀察:
- 取得生物樣品快速活動的高解度影像
例如: Signaling processes (如: 鈣離子攝影),Cytoskeletal dynamics (如: actin-based motility processes 或 tubulin dynamics ),細胞的Membrane trafficking
- 相較於一般共軛焦顯微鏡,轉盤式共軛焦顯微鏡系統有較低 phototoxicity 與photo bleaching的特性,較適合對photo damage敏感的實驗。
例如: cell cycle associated processes,Long-term timelapse imaging of cellular processes
- 可廣泛運用於希望提升影像解析度或加速影像擷取的實驗。
 DATA圖片
DATA圖片